通过合成生物学和工程学思想,可以实现对细胞有目的的设计、改造和重编程。装载有可控基因线路的人工定制细胞,就像一个智能的“细胞药物工厂”,通常情况下处于休眠状态,当接收到外界指令,如小分子药物、疾病标志物或光信号时,定制细胞会对其进行处理和计算,以可预测及精准可控的方式生产并释放蛋白药物。
然而,现有的人工定制细胞对外界指令的响应和处理缓慢,对治疗蛋白的表达和释放大部分都局限于转录或翻译水平的调控,无法实现对目标蛋白的可控快速释放。缓慢的响应速度带来了两个方面的问题:1)不符合部分细胞需要迅速释放蛋白质的要求。生理状态下,许多细胞对外界生理信号的响应十分迅速,如胰岛细胞感受血糖升高释放胰岛素;2)不适用于治疗有即时用药需求的疾病如哮喘、急性心梗、心绞痛等。
2023年10月23日,华东师范大学生命科学学院、上海市调控生物学重点实验室、医学合成生物学研究中心叶海峰团队在 Nature Chemical Biology 期刊发表了题为:A programmable protease-based protein secretion platform for therapeutic applications 的研究长文。该研究开发了精准可控的蛋白质快速释放系统——PASS,通过直接调控蛋白质的释放而不是转录表达,实现了对治疗蛋白分钟级别的可控释放。

PASS系统的设计灵感来自于蛋白质的释放和分选原理。经典的蛋白质释放路径需要经过基因转录、剪接、翻译、加工等步骤最后释放到细胞膜外。然而,有一类蛋白质 (如内质网功能蛋白) 经过高尔基体加工后并不会释放到细胞外,而是被膜衣蛋白复合体COP1的识别,重新运输回收定位到内质网上,行使相应的生物学功能,该过程依赖于由四个氨基酸组成的内质网回收信号(-KKXX-COOH,其中X表示任意氨基酸)。
根据上述原理,叶海峰团队研究人员将内质网回收信号KKXX融合表达在分泌蛋白的羰基末端,使目的蛋白提前翻译好,锚定储存在细胞内质网中,以备用时之需。他们在内质网回收信号和目的蛋白之间融合了一段可以被蛋白酶识别的肽链,当其被蛋白酶水解切除时,锚定在内质网上的治疗蛋白就会迅速释放到细胞外。研究人员通过化学小分子药物、肿瘤抗原以及光来控制蛋白水解酶活性,分别开发了三种精准可控的蛋白质快速释放系统:chemPASS、antigenPASS和optoPASS。
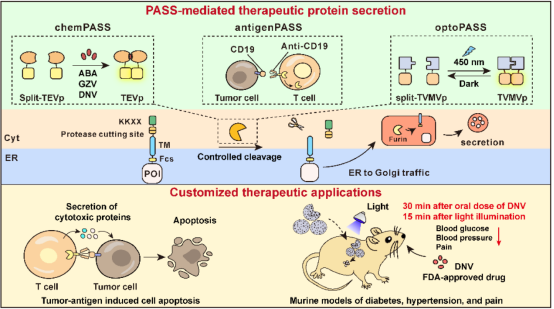
首先,他们通过小分子诱导的异源蛋白二聚系统来调控分裂版烟草蚀斑病毒蛋白酶split-TEVp的活性,开发了三种安全无毒的小分子调控的蛋白质快速释放系统—chemPASS。他们将装载有chemPASS基因线路的定制细胞移植到糖尿病小鼠体内,当小鼠口服临床批准的抗病毒药物danoprevir后,仅需30分钟就可有效诱导胰岛素的释放,实现快速降血糖效果。

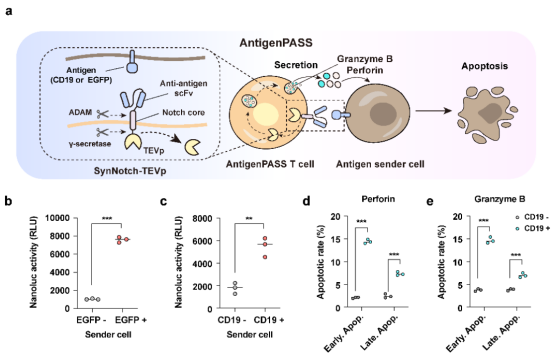
接着,结合肿瘤免疫疗法设计理念,研究人员开发了肿瘤抗原激活的杀伤蛋白释放系统——antigenPASS。他们将TEVp蛋白酶通过synNotch (synthetic Notch) 受体锚定在细胞膜上,当细胞识别肿瘤抗原后,TEVp从细胞膜脱落,从而诱导储存在内质网上的蛋白质快速释放。实验证明,装载有antigenPASS的免疫T细胞可精准识别肿瘤细胞,快速释放杀伤蛋白(颗粒酶、穿孔素),从而有效杀死肿瘤细胞 。
最后,研究人员通过Magnets蓝光诱导的二聚化系统来调控分裂版烟草脉斑驳病毒蛋白酶split-TVMVp的活性,在PASS系统的基础上设计构建了光调控的蛋白质快速释放系统—optoPASS,实现了远程无痕、高度时空特异调控的蛋白质快速释放。只需要一束光,就可以诱导装载有optoPASS基因线路的人工定制细胞快速释放降压肽、降糖肽、止疼肽。实验证明,光照15分钟即可在糖尿病、高血压、疼痛模型小鼠体内发挥降血糖、降血压以及镇痛的效果。
综上,该研究开发的PASS系统具有灵活可变、快速处理外界指令,并在分钟级别释放蛋白药物的特点,为精准可控的基因治疗和细胞治疗提供了全新的控制遗传学系统。