胶质母细胞瘤(GBM)是最常见和最致命的成人原发性脑肿瘤,5年生存率仅为10%左右。其对治疗具有明显的耐药性,目前的标准疗法只能对GBM患者提供适度缓解,会在手术和放化疗后快速复发。而复发性GBM(rGBM)患者的生存期不足10个月 。
除了手术和放化疗,传统免疫疗法也对复发性GBM(rGBM)无效,这被认为是由于高度免疫抑制性的肿瘤微环境(TME)导致浸润性抗肿瘤淋巴细胞的缺乏。对于rGBM和其他几种高度免疫抑制的实体癌,需要找到治疗方法,将其抑制性肿瘤微环境转化为更适合免疫治疗和免疫激活的肿瘤微环境。
溶瘤病毒(Oncolytic Viruses,OVs)是一种有前途的实体瘤治疗方法。注射到肿瘤内后,溶瘤病毒能够选择性以癌细胞为目标,而不影响正常细胞,通过在癌细胞内复制,导致癌细胞裂解。此外,溶瘤病毒还能进一步刺激免疫系统,因此可以与其他癌症免疫疗法结合使用,例如免疫检查点抑制剂。目前,共有4款溶瘤病毒疗法获批上市,通过肿瘤内注射治疗黑色素瘤、结直肠癌、胶质瘤等多种癌症。
然而,溶瘤病毒治疗复发性GBM(rGBM)一直缺乏足够的数量以进行与治疗结果相关的免疫学特征分析。
2023年10月18日,哈佛医学院布列根和妇女医院的研究人员在国际顶尖学术期刊 Nature 上发表了题为:Clinical trial links oncolytic immunoactivation to survival in glioblastoma 的研究论文。
该研究设计了一种新的溶瘤病毒疗法,可以感染癌细胞并刺激抗肿瘤免疫反应。这项1期临床试验这种新型基因疗法在高级别胶质瘤患者中的安全性和初步疗效,显著延长了存在HSV1抗体的复发性胶质母细胞瘤患者亚组的生存期。

胶质母细胞瘤(GBM)具有侵袭性作用,部分原因是肿瘤周围的免疫抑制性肿瘤微环境,通过阻止免疫系统进入和攻击肿瘤,从而促进肿瘤生长。研究团队设计了一种新的溶瘤病毒疗法,并进行了临床前实验,然后授权给了Candel Therapeutics,该公司将这一溶瘤病毒疗法命名为CAN-3110,并进行了这项临床1期、first-in-human的临床试验。
这一溶瘤病毒疗法使用的是溶瘤单纯疱疹病毒(oHSV),这种病毒与已被批准用于治疗转移性黑色素瘤的溶瘤疗法中的病毒类型相同。但不同的是,该疗法中使用的溶瘤病毒包括ICP34.5基因,该基因通常被排除在临床oHSV之外,因为它编码的神经毒性因子会引起人类疾病。
而在这项最新研究中,研究团队认为,ICP34.5可能是出发攻击肿瘤的强大的促炎反应所必需的。因此,研究团队设计 一种含有ICP34.5基因的oHSV1,使用巢蛋白启动子(nestin promoter)启动其表达, 该启动子在GBM和其他侵袭性肿瘤中过表达,但在成粘人大脑或健康分化组织中不表达,因此,该溶瘤病毒携带的ICP34.5不会攻击健康大脑细胞。
总体而言,该临床试验证明了CAN-3110疗法在41例高级别胶质瘤患者中的安全性,其中包括32例复发性GBM(rGBM)患者。最严重的不良事件是两名参与者的癫痫发作。值得注意的是,先前存在HSV1病毒抗体的GBM患者(66%的患者)的中位总生存期为14.2个月。在已存在抗体的患者中,研究团队发现了与免疫激活相关的肿瘤微环境的几种变化标记。
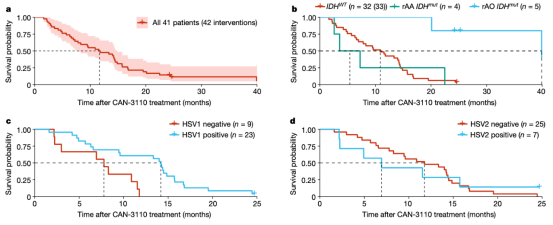
研究团队猜测,HSV1抗体的存在导致了身体对病毒的快速免疫反应,这给肿瘤带来了更多的免疫细胞,并增加了肿瘤微环境中的炎症水平。在CAN-3110治疗后,研究团队还观察到T细胞库多样性的增加,这表明病毒诱导了广泛的免疫反应,可能是通过消除肿瘤细胞,导致了癌症抗原的释放。治疗后的这些免疫变化也被证明与患者生存率的提高有关。
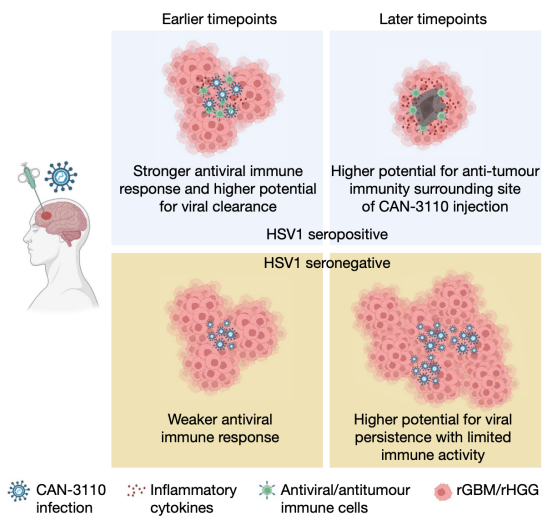
展望未来,研究团队计划完成前瞻性研究,以进一步调查溶瘤病毒在有和没有HSV1抗体的患者中的有效性。在证明了一次病毒注射的安全性之后,他们正着手在四个月内测试多达六次注射的安全性和有效性,这就像多轮疫苗接种一样,可能会增加治疗的有效性。
该研究的领导者 E. Antonio Chiocca 教授表示,几乎没有针对GBM的免疫疗法能够增加对这些肿瘤的免疫浸润,而这项临床研究中的溶瘤病毒引发了引发了非常活跃的免疫反应,伴随着肿瘤杀伤性T细胞的浸润,在GBM中很难做到这一点,所以这项研究令人兴奋,给了我们推进下一步的希望。