玻璃体视网膜疾病包括一系列威胁视力的疾病,可导致严重的不可逆视力丧失。目前临床对玻璃体视网膜疾病的治疗效果普遍不理想,治疗往往会产生一些副作用。此外,经常需要反复治疗,导致患者依从性差。
近年来,研究人员探索了细胞治疗眼科疾病的可能性。尽管取得了一些积极的成果,但细胞治疗在眼科领域遇到了一系列问题,例如细胞存活率低、细胞表型不稳定以及需要严格的储存条件等等,这些都限制了这些细胞治疗技术的临床可行性。
2023年10月23日,北京朝阳医院陶勇、中国科学院过程工程研究所魏炜、马光辉院士等在 Nature 子刊 Nature Biomedical Engineering 上发表了题为:Exosome-loaded degradable polymeric microcapsules for the treatment of vitreoretinal diseases 的研究论文。
该研究开发了一种基于自愈合微球装载外泌体的新型“假细胞”配方,用于治疗多种玻璃体视网膜疾病。

许多基于细胞的治疗方法的益处涉及旁分泌机制。因此,在有研究团队探索了使用更稳定的细胞分泌成分(例如外泌体)作为治疗成分来治疗眼部疾病的可行性。
受此启发,北京朝阳医院陶勇团队中国科学院过程工程研究所马光辉/魏炜团队展开了合作。提出了一个“假细胞”配方平台。在这个平台上,从细胞中分离的外泌体(Exosomes)被装载到了由聚乳酸-羟基乙酸共聚物(PLGA)构成的具有微孔的自愈合微球(Self-healing microcapsules)中,研究团队将其称为——ExoCaps。马光辉院士表示,ExoCaps在大小、内部结构和分泌行为方面模拟了功能细胞。
向眼睛玻璃体内注射后,ExoCaps在玻璃体腔下部沉淀。由于活细胞悬浮在玻璃体腔内可引起视力模糊,因此将ExoCaps放置在其下部区域可以避免视力模糊。此外,外泌体随着微球在一个月内的降解而逐渐释放,为长期治疗效果铺平了道路。
通过使用视网膜缺血再灌注损伤(RIRI)和分枝杆菌葡萄膜炎(PMU)模型,研究团队检测了两种不同的ExoCap配方的应用,分别基于间充质干细胞来源的外泌体(MExo)和Treg细胞来源的外泌体(TrExo)的微球。
在视网膜缺血再灌注损伤(RIRI)的小鼠模型的眼睛玻璃体腔内注射,装载了小鼠间充质干细胞来源的外泌体(MExo)的ExoCap在玻璃体腔下部定植,在降解过程中释放外泌体超过一个月,并导致视网膜厚度恢复到接近健康视网膜的水平。
而在分枝杆菌葡萄膜炎小鼠和非人类灵长类动物模型中,玻璃体腔内注射装载了猴Treg细胞来源的外泌体(TrExo)的ExoCap,导致炎症细胞水平显著降低。
魏炜研究员表示,ExoCap平台非常灵活,可以负载不同细胞来源的外泌体,以满足不同的治疗需求。
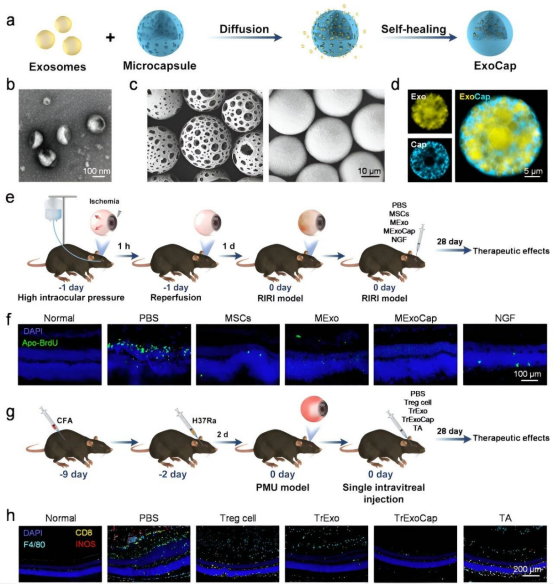
研究团队在小鼠以及非人灵长类动物的玻璃体视网膜疾病模型中均验证了这一基于自愈合微球装载外泌体的新型“假细胞”的治疗潜力。这种可冻干保存的封装外泌体的微球可能为玻璃体视网膜疾病提供替代治疗选择。
论文共同通讯作者、北京朝阳医院陶勇教授表示,这项研究仍处于临床前阶段,但考虑到外泌体是内源性细胞产生的天然囊泡,具有良好的生物相容性,而构成自愈合微球的材料聚乳酸-羟基乙酸共聚物(PLGA)已被批准用于临床,因此,ExoCap有潜力转化到临床应用。